TMB历经风雨终转正 | NGS大Panel助力实体瘤免疫治疗
2020年6月16日,FDA批准帕博利珠单抗(Keytruda,K药)单药治疗 TMB-H(组织TMB≥10个突变/Mb),既往治疗后疾病进展且没有令人满意替代治疗方案的不可手术或转移性的成人和儿童实体瘤患者。
这是继MSI-H/dMMR作为泛瘤种生物标志物于2017年获批后,Keytruda获批的第二个基于生物标志物的“不限癌种”癌症疗法。

▲Keytruda药物标签更新部分(图片来源:参考资料[1])
TMB历经风雨终转正
TMB(肿瘤突变负荷),一种包括肺癌在内的泛实体瘤免疫治疗新兴且独立的预测生物标志物,即每兆碱基(每1百万个碱基)中体细胞突变的数目(mut/Mb)。
肿瘤突变负荷高(TMB-H)的肿瘤可能具有更高的新抗原率,其与肿瘤微环境和周围的抗癌T细胞增加密切相关。从原理上讲,与肿瘤突变负荷低(TMB-L)的肿瘤相比,TMB-H的肿瘤具有更高的免疫原性。因此,TMB-H表明免疫治疗反应的可能性更高。
2014年,TMB概念提出并成为一种新兴肿瘤免疫治疗生物标志物,开始进入“试用期”;经历6年是非争议,此次FDA正式批准标志着同意“TMB转正”。
K药不限癌种又添新靶标
Keytruda是FDA历史上批准的第一款依靠通用的特殊标志物,而不是肿瘤发生位置来划分治疗范围的肿瘤治疗药物。此次获批,Keytruda的通用标志物又增加了TMB这一指标。
以往的研究表明,在TMB-H的患者中,同时出现MSI-H的患者比例在15%~40%之间(如何定义TMB-H对这一数值影响很大),因此如果能够使用TMB-H作为筛选癌症患者的分子生物标志物,那么检查点抑制剂就可能造福更多患者。
· 2017年5月23日,FDA批准了Keytruda用于治疗带有微卫星不稳定性高(microsatellite instability-high,MSI-H)或错配修复缺陷(mismatch repair deficient,dMMR)的实体瘤患者。
· 2020年6月16日,FDA批准帕博利珠单抗(Keytruda,K药)单药治疗 TMB-H(组织TMB≥10个突变/Mb),既往治疗后疾病进展且没有令人满意替代治疗方案的不可手术或转移性的成人和儿童实体瘤患者。
TMB检测,需要NGS大panel
TMB的标准化检测问题有许多,其最基本的要求就是必须使用NGS大panel(或WES)进行检测。目前的建议是使用超过300基因的 NGS 大panel进行检测(覆盖率最好大于 1.0 MB)。

▲ TMB检测需要>300基因或>1Mb大panel
目前FDA批准了F1CDx用于tTMB的检测,国内NPMA尚没有批准TMB的检测产品。
Biomedlab 伯全康/益panel助力TMB检测
针对TMB检测,伯豪医学检验也有自己的检测项目——伯全康/益panel,各项参数均满足FDA的相关要求:
基因覆盖为2.9Mb,选取的基因(基因数500+)绝大多数为FDA批准的NGS体外检测基因。

伯全康/益panel 评估TMB采用与F1CDx相同的算法,分析后得出,tTMB(组织TMB)、bTMB(血浆TMB)与WES结果的一致率分别为96%、73%。
在TMB阈值划分方面,伯豪医学基于6万余例实体瘤患者的公共测序数据,并参比对照了F1CDx panel(324基因)、MSK IMPACT panel(468基因),最后建议TMB≥10.57/Mb为TMB-H,旨在为临床提供更准确的阈值参考。
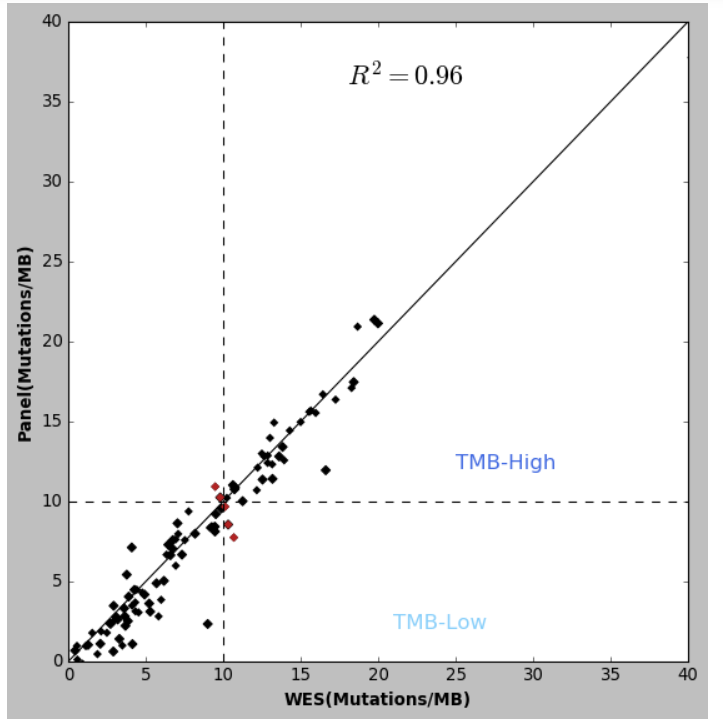
▲ 伯全康panel检测肿瘤突变负荷 VS
全外显子测序(WES)检测肿瘤突变负荷
伯全康/益,是利用高通量测序技术(NGS)对560个基因进行深度测序(组织版 >1000X、血液版 >10000X)的panel。
√ 覆盖基因几乎可包含所有与肿瘤发生通路的基因
√ 可检测肿瘤患者TMB/bTMB水平(与WES一致性如下图)
√ 可用于抗肿瘤药物(含获批及在研药物)筛选、免疫药物疗效评估、家族遗传性肿瘤分析及科学研究等
伯全康/益是伯豪医学目前最全面也最有潜力的肿瘤药物评估panel,在技术方面,结合对panel的深度测序,旨在为肿瘤患者获得有效的免疫治疗评估提供强有力的保障。
参考资料:
[1] Keytruda label. Retrieved June 16, 2020, from https://www.accessdata.fda.gov/drugsatfda_docs/label/2020/125514s071s090lbl.pdf

